V dnešním příspěvku probereme, proč je většina molekul bezbarvá, představíme si užitečnou techniku UV-viditelné spektroskopie a nakonec vysvětlíme proč molekuly jako chlorofyl a β-karoten jsou zbarveny.
Na závěr vám dokonce ukážeme, jak použít UV-Vis spektrum k předpovědi barvy molekuly, což je skvělý trik, který můžete použít na večírcích. Ne, vážně, je to neuvěřitelné. Mluvíme o pochopení chemie barev, všichni! Lepší to nebude.
Nejprve shrnutí. Níže si projdeme podrobnosti.
Obsah
- Převod frekvenčních jednotek na energetické jednotky
- Elektrony základního stavu mohou být povýšeny do excitovaných stavů prostřednictvím absorpce světla
- Případová studie: Molekulární orbitální diagram H2
- Proč je většina molekul obsahujících pouze jednoduché vazby bezbarvá
- Pi vazby absorbují delší a energeticky dostupnější vlnové délky
- UV-Vis spektrometr
- Jak konjugace Pi vazeb ovlivňuje Lambda Max?
- Jak souvisí Lambda Max s barvou, kterou vnímáme?
- Závěr: UV-Vis spektroskopie
- Poznámky
1. Převod frekvence světla na energetické jednotky
Pokud chcete, aby si někdo přečetl něco, co jste napsali, začínat rovnicí je obecně špatný nápad. Začneme však jedním z nejkrásnějších, nejúžasnějších a nejprostších užitečný rovnice v celé vědě. Takže pokud po přečtení tohoto článku odejdete, je to opravdu váš problém.
Z obecné chemie si možná vybavíte nesmrtelnou rovnici
kde E je energie, h je Planckova konstanta (6.626 × 10-34 m 2 kg/s) a ν je frekvence (v m -1 ) .
Proč je tato rovnice tak zatraceně užitečná? Protože to dává energii do souvislosti s frekvencí světla.
Přesněji řečeno, když říkám „světlo“, myslím tím „foton“, jako nosič elektromagnetického záření. Pro účely dnešního příspěvku je zde část elektromagnetického spektra, o které dnes budeme diskutovat: UV a viditelné frekvence.
2. Elektrony v základním stavu mohou být povýšeny do excitovaných stavů prostřednictvím absorpce světla
V obecné chemii (Bohrův model atomu vodíku, někdo?) jste viděli, jak může být elektron podporován z základní stav orbitální k an vzrušený stav orbitální prostřednictvím absorpce fotonu o frekvenci:
[kde ΔE je rozdíl v energii mezi základním a excitovaným stavem].
Protože se jedná o elektron, který se přenáší z jedné energetické úrovně na druhou, nazýváme je „elektronické přechody“. Obecně je frekvence záření požadovaná pro elektronické přechody v ultrafialová a viditelná část elektromagnetického spektra.
To má praktický význam v mnoha ohledech, ale pro naše účely uvidíme, že nejvýznamnější je, že světlo může podporovat elektrony z lepení orbitaly do proti lepení orbitaly, a proto potenciálně vedou k rozbití chemických vazeb.
To nám pomůže pochopit:
- proč molekuly vůbec absorbují UV světlo (sigma -> sigma* přechody)
- proč je UV záření extrémně škodlivé (zejména vzdálené UV záření)
- a nakonec, proč mají určité molekuly barvu (přechody pi –> pi*)
Začněme nejjednodušší molekulou, vodíkem (H2) a stavět odtud.
3. Případová studie: Molekulární orbitální diagram pro molekulární vodík (H2)
Na začátku vašeho kurzu organické chemie jste pravděpodobně viděli, jak se atomové orbitaly mohou překrývat a vytvářet molekulární orbitaly.
Ve vodíku (H2), například dva 1s atomový orbitaly překrývají se a tvoří dvě sigma ( σ) molekulární orbitaly. Počet orbitalů je vždy zachován: protože začínáme dvěma atomovými orbitaly, končíme dvěma molekulárními orbitaly.
Konstruktivní překrytí vede k vytvoření sigma (σ)orbitalu s nižší energií. Destruktivní překrytí vede k vytvoření sigma hvězdy (σ*) orbitalu s vyšší energií. Tyto dva orbitaly se liší energií ΔE .
Vzhledem k tomu, že každý atom vodíku přináší do party jeden elektron, máme dva elektrony, kterými zaplníme naše molekulární orbitaly, a ty nejprve zaplní orbitaly s nižší energií – podobně jako když se nikdo nerozhodne stát v uličce městského autobusu (vyšší energie), když je přítomno prázdné sedadlo (nižší energie).
To nám dává diagram, který vypadá takto: (Pokud vás to zastrašuje, zaměřte se na tu červenou ΔE ).
Že ΔE je důležitý: analogicky k Bohrově modelu, pokud molekulární vodík (H2) je vystaven frekvenčnímu světlu
elektron bude podporován z molekulárního orbitalu v základním stavu (sigma). nejvyšší obsazený molekulární orbitalnebo HOMO) k excitovanému molekulárnímu orbitalu sigma* ( nejnižší neobsazený molekulární orbital or LUMO).
Je to trochu jako, když batolata lezou po schodech, jeden krok po druhém: jedna noha stoupá z nejvyšší obsazený stupeň k nejnižší neobsazený schoda energie nezbytná k tomu je určena rozdílem ve výšce mezi stupni.
Nyní můžeme pomocí rovnice převést frekvenci na vlnovou délku
c = ν λ (c je rychlost světla, λ je vlnová délka).
Pro vazbu H-H v H2, AE odpovídá naměřenému maximu absorpční vlnové délky 112 nm, který je hluboký, hluboký, hluboký v UV oblasti elektromagnetického spektra.
4. Proč je většina molekul obsahujících pouze jednoduché vazby bezbarvá
112 nm není přesně oblast solária UV. Ne, toto je část paprsku smrti v UV spektru. Je to proto, že UV záření pod 120 nm je také místem, kde absorbují běžné sigma vazby, jako jsou C-H a C-C, a proto vystavení vzdálenému UV světlu by rychle roztříštilo vazby tvořící proteiny, cukry a DNA přítomné v našem těle a obrátilo nás. jít.
Pojďme si to ujasnit.
Většina jednoduchých (tj. sigma) vazeb jako C-C, C-H, O-H a C-O má hodnoty AE, které odpovídají světlu v hluboké UV části spektra. Zdá se nám, že jsou bezbarvé, protože světlo ve viditelné oblasti (400-700 nm) jednoduše nemá dostatek energie k vybuzení jejich vazebných elektronů do excitovaného stavu.
Proto je voda bezbarvá. Proto je ethanol bezbarvý. To je důvod, proč jsou diethylether, hexany, chloroform a řada dalších molekul, se kterými se setkáváte v laboratoři i v každodenním životě, bezbarvé: ΔE pro vazebné orbitaly je příliš velké pro relativně nízkoenergetické fotony viditelného světla k jejich excitaci. [Vložit vtip Jeba Bushe?]
Ve skutečnosti je UV v oblasti pod 120 nm tak energetické, že je zcela absorbováno atmosférickým O2 a N2. Jinými slovy, pokud chcete změřit přesné vlnové délky, které, řekněme, ethanol absorbuje, museli byste jej umístit do vakuové komory a vystavit tvrdému UV záření. To je samozřejmě akademického zájmu, ale mimo rámec typického úvodního kurzu. Pro naše účely nebudeme dále diskutovat o přechodech sigma → sigma*.
Sečteno a podtrženo: obecně nepozorujeme přechody sigma → sigma*.
[Jednou výjimkou, se kterou se setkáváme, jsou dihalogeny jako Cl2 a já2 které mohou absorbovat viditelné světlo a vytvářet volné radikály prostřednictvím homolytického štěpení sigma vazeb. Toto je příklad rozbití sigma vazeb prostřednictvím absorpce UV nebo viditelného světla, které je možné díky tomu, že tyto vazby jsou poměrně slabé, asi 50-60 kcal/mol, a odpovídající ΔE je malé ].
5. Pi (π) vazby absorbují na delších, dostupnějších vlnových délkách
OK: přechody σ→σ* budeme ignorovat. Pojďme si tedy místo toho promluvit o přechodech π-π*.
Tady to začíná být zajímavé a relevantní.
Připomeňme si, o čem mluvíme, tím, že začneme s jednoduchou molekulou. Zde je ethen (aka „ethylen“), nejjednodušší alken. Letmý pohled na jeho strukturu odhalí 5 sigma vazeb a jedna pí vazba.
- Připomeňme, že sigma dluhopisy jsou výsledkem “konec” překrývají se mezi orbitaly s nebo sp n (sp, sp 2 nebo sp 3 ), zatímco vazby pi jsou výsledkem “na boku” vazba sousedních p orbitalů.
- Jsou-li všechny ostatní stejné, π vazby jsou slabší než srovnatelné sigma vazby, protože je zde menší orbitální překrytí.
- Slabší vazby znamená, že energetická mezera ΔE mezi π (HOMO) a π* (LUMO) bude odpovídajícím způsobem menší. [V naší analogii kratší schod na schodišti vyžaduje méně energie na výstup].
- Protože ΔE je menší pro pí vazbu to odpovídá a delší vlnová délka (Ze dne nižší frekvence) potřebný k excitaci elektronu z pí na orbital pí*.
Pro ethen je absorpční maximum vlnové délky pro tento přechod pi-pi* asi 170 nm: stále v hlubokém UV, ale ne tak extrémní jako u odpovídající C-C sigma vazby.
Očekávali bychom, že etylen bude bezbarvý, a je tomu tak: pouze absorbuje poněkud blíže viditelné části spektra než například ethan.
Pojďme si to ilustrovat na obrázku, který studentům často připadá děsivý: orbitální energetický diagram.
*Varování spouště* Vše, co se toto číslo snaží ukázat, je toto ΔE pro vazbu C-C π ( zeleně ) je menší než ΔE pro vazbu C-C σ ( v šedé) . Pokud to pochopíte, pochopili jste klíčový bod.*
Počkejte chvíli, dalo by se říct. Jak my? Vědět že ethen absorbuje světlo v UV kolem 170 nm?
Jsem rád, že ses zeptal. Pojďme si představit velmi důležité zařízení zvané a UV-Vis spektrometr.
6. UV-Vis spektrometr
Základní myšlenkou UV-Vis spektroskopie je vyzařovat světlo o různých vlnových délkách skrz vzorek a změřte absorbanci při každé vlnové délce. Silně budou absorbovány pouze vlnové délky odpovídající ΔE pro elektronický přechod. [Pro schéma toho, jak spektrometr funguje: zkontrolujte toto výborná stránka, což je také vynikající alternativní vysvětlení UV].
UV-Vis spektrum znázorňuje absorbanci (nebo její inverzní propustnost) vzorku v závislosti na vlnové délce. Zde je spektrum ethenu. [V tomto případě je vlnová délka vynesena proti propustnosti, inverzní k absorbanci (vysoká absorbance = nízká propustnost a naopak). ]
Všimněte si, že vlnová délka maximální propustnosti je na 174 nm. Říkáme tomu λmax , vyslovováno „lambda max“. Při této vlnové délce prochází vzorkem velmi málo světla, protože vlnová délka velmi těsně odpovídá ΔE pro přechod π do π*.
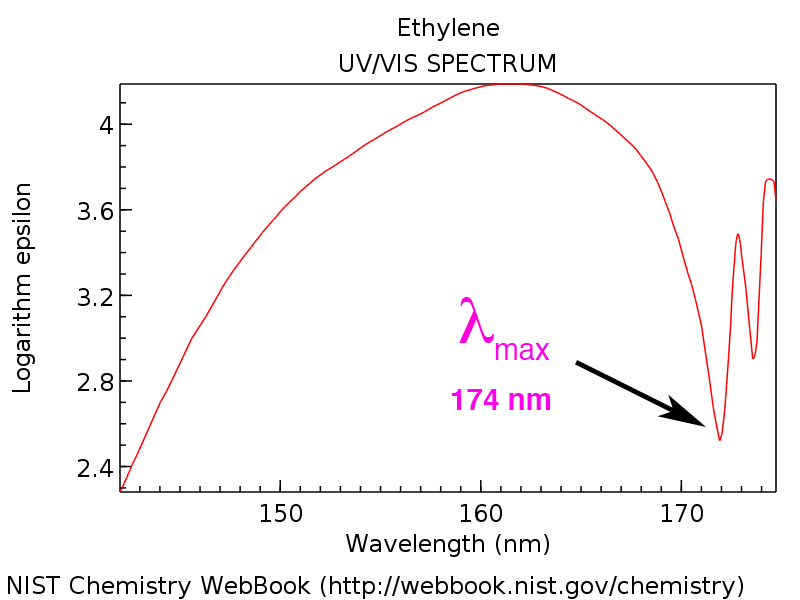
UV-Vis spektrometr je užitečným nástrojem, protože nám umožňuje zachytit přesně tam, kde vzorky absorbují světlo, a tak vyčíslit elektronické přechody. Například s vědomím, že λmax pro ethen je na 174 nm nám umožňuje vypočítat energetickou mezeru ΔE , která se ukáže být asi 164 kcal/mol.
7. Jak konjugace Pi vazeb ovlivňuje λmax ?
V naší předchozí příspěvek o přírodních pigmentech, poznamenali jsme, že jejich velké množství konjugovaných pí vazeb byl zodpovědný za jejich barvy.
UV-Vis spektroskopie nám pomáhá porozumět jak přesně souvisí konjugace s λmax molekuly – a tím i její barvy (nebo jeho nedostatek).
Podívejme se například, co se stane s λmax kdy zvětšíme délku konjugace z 1 (ethen) na 2 (butadien) na 3 (hexatrien).
Jak se zvyšuje počet konjugovaných pí vazeb, λmax se také zvyšuje!
Protože delší frekvence = menší energie, znamená to, že energetická mezera ΔE mezi nejvyšším obsazeným molekulárním orbitalem (HOMO) a nejnižším neobsazeným molekulárním orbitalem (LUMO) klesá jako počet konjugovaných pí vazeb zvyšuje.
Zde je návod, jak (zhruba) vypadá obrázek spojení. Opět se soustřeďte pouze na AE: s rostoucím počtem konjugovaných pí vazeb se zmenšuje.
Jak tento trend pokračuje kolem hexatrienu směrem k molekulám s delší konjugační délkou, λmax se začne plížit do viditelné oblasti spektra. Je již na 258 nm pro délku konjugace 3. Barva se začne objevovat, když se délka konjugace přiblíží 7 nebo tak. [Například amfotericin B má 7 konjugovaných pí vazeb a absorbuje kolem 403 nm, ve fialové.]
Naši staří přátelé lykopen (λmax 471 nm), β-karoten (λmax 452 nm) a lutein (λmax 445 nm) mají ještě větší pí systémy (10 a 11) a absorbují viditelné světlo dále směrem k červené. [Poznámka 2]
Tak, λmax molekul je z velké části funkcí délky konjugace: se zvyšujícím se počtem konjugací se zvyšuje i λmax.
Ale jedna otázka zůstává:
8. Jak funguje λmax Souvisí s barvou, kterou vnímáme?
Jeden poslední kousek skládačky. Jak se projeví vlnová délka maximální absorbance (λmax) se týkají skutečného barva?
Za prvé, osvěžení z minulého příspěvku. Vidíme doplňkovou barvu hlavní barvy, která je absorbována. Molekula, která absorbuje v modrý Objeví se oranžový, protože vnímáme barvy, které jsou odráží, a oranžový je doplňková barva modré.
Například tato molekula, Rhodamin B [Poznámka 3] absorbuje při asi 560 nm (zelená) a objeví se červený , doplňková barva zelené.
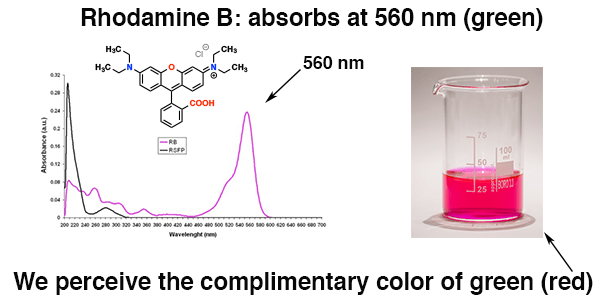
Vědět, kde molekula absorbuje viditelné světlo, nám umožňuje předpovídat její barvu. Zajímavý!
Myslím, že to je docela ošklivý trik na koktejlové párty. Myslete na to, až se příště podíváte na list, rajče, mrkev nebo krev žlutého raka.
Mohli bychom pokračovat (a budeme!). Ale zatím to tam nechme.
BTW: Fantastické zpracování UV-Vis spektroskopie s méně jibber-jabberem napsal Tim Soderbergh na LibreText. Koukni na to.
Také Reuschova online učebnice o UV-Vis spektroskopii je o tomto tématu podrobnější a bohatší na hluboké detaily než tento příspěvek.
9. Závěr: UV-Vis spektroskopie
Tento příspěvek prošel určitou teorií za UV-Vis spektry.
V příštím příspěvku se podíváme na některé z praktičtějších aspektů UV-Vis spektroskopie. Jaké otázky nám může UV-Vis pomoci zodpovědět o neznámé molekule?
Poznámky
Související články
- Konjugace a barva (+ Jak funguje bělidlo)
- Konjugace A Rezonance V Organické Chemii
- UV-Vis spektroskopie: Absorbance karbonylů
- UV-Vis spektroskopie: Praktické otázky
- IR spektroskopie: 4 praktické problémy
- Infračervená spektroskopie: Rychlý základ pro interpretaci spekter
Poznámky 1. Co v této diskusi chybí?
λmaxnení Výhradně funkce počtu pí vazeb. Pokud by to byla pravda, lykopen (11 konjugovaných pí vazeb) a b-karoten (také s 11 konjugovanými pí vazbami) by měly přesně stejnou barvu. Nemají, protože λmax je také ovlivněna substituenty, jako jsou připojené alkylové skupiny, ať už je pí vazba uvnitř nebo vně kruhu (endocyklický / exocyklický) a připojené heteroatomy.
Ve 1940. letech XNUMX. století, kdy UV-Vis byla prakticky jediná dostupná spektroskopická metoda, Woodward a Fieser vyvinuli soubor empirických pravidel (Woodward-Fieserova pravidla), jejichž cílem bylo předpovědět λ.max na základě řady strukturálních faktorů. Existují také varianty těchto pravidel pro složitější konjugované systémy (Fieser-Kuhnova pravidla).
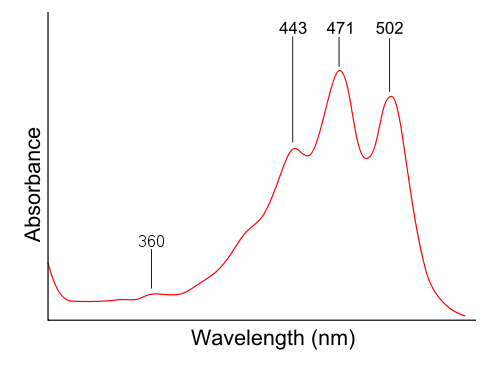
Poznámka 2. Rád bych jako příklady použil UV-vis spektra přírodních pigmentů, jako je lykopen a chlorofyl, ale obsahují více než jedno maximum. To není snadné vysvětlit. Proto není tak jednoduché převést do barvy jako Rhodamin B. Zde je například lykopen (zdroj: wikipedia)
Poznámka 3. Chybí zde také důvod, proč jsou UV-Vis spektra široká a ne přímé čáry. Například, pokud, řekněme, rhodamin má delta E, která odpovídá světlu 560 nm, proč také absorbuje světlo při 559 a 561 nm? Část odpovědí je, že vazby jsou v konstantní vibraci a to upravuje hodnotu delta E, takže je absorbována řada energií.
Poznámky 4. [Jak daleko to můžeme zajít? V úplném extrému máte grafen, což je jen velký plochý konjugovaný pí systém s téměř nekonečným počtem konjugovaných pí vazeb. V této situaci téměř každá vlnová délka světla odpovídá nějakému druhu přechodu pi-pi* a výsledkem je černá barva.]















